Produzione di idrossido di sodio o di fluoro gassoso, galvanoplastica, raffinazione del rame sono soltanto alcuni esempi di processi industriali che sembrano molto diversi tra loro, ma sono accomunati dallo stesso principio di funzionamento: l’elettrolisi. Nell’elettrolisi, studiata da Faraday nella prima metà dell’800, delle trasformazioni chimiche avvengono per effetto dell’elettricità.
Analogamente a quanto avviene in una pila, anche in una cella elettrolitica si ritrovano elementi come catodo ed anodo, immersi in una soluzione elettricamente conduttiva.
Al sistema viene però fornito lavoro dall’esterno, instaurando una differenza di potenziale tra i due elettrodi, ed il circuito viene chiuso dalle specie elettricamente cariche presenti in soluzione, che migrano spinte dal campo elettrico.
Queste ultime sono poi interessate da reazioni di ossidazione (anodo) o di riduzione (catodo), che avvengono in corrispondenza degli elettrodi.
Elettrolisi in ambito industriale
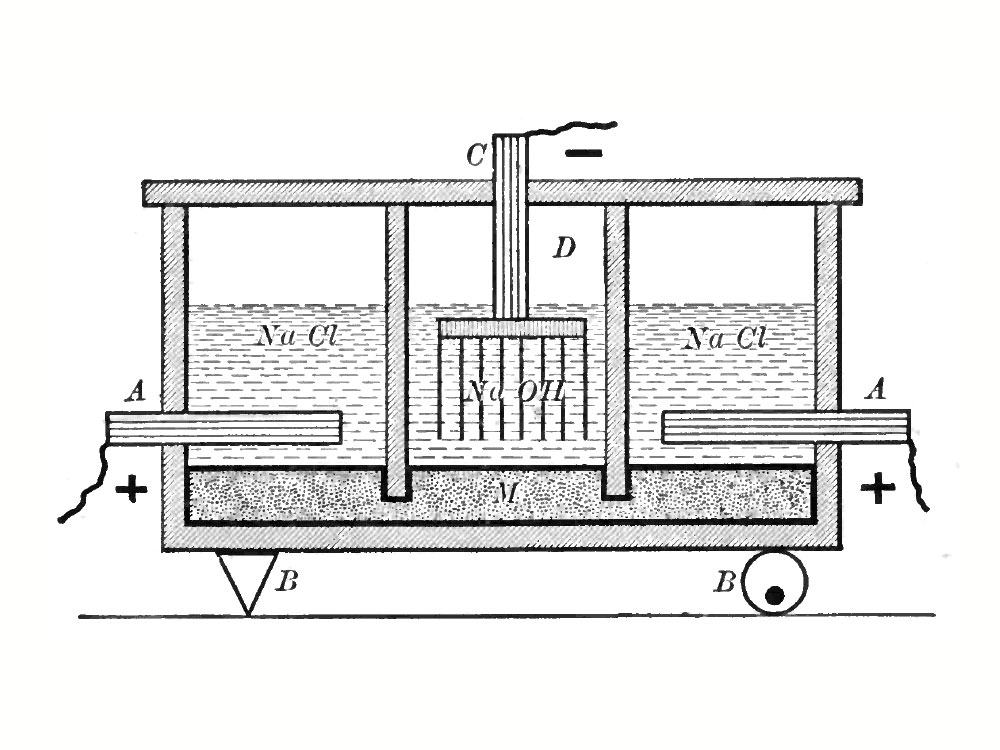
In ambito industriale il processo si presta a molteplici applicazioni. Due dei più importanti prodotti della chimica di base, il cloro e l’idrossido di sodio, sono ottenuti proprio ricorrendo all’elettrolisi di soluzioni a base di Cloruro di Sodio (NaCl), operando in condizioni tali da promuovere lo sviluppo di cloro gassoso all’anodo, e di idrogeno al catodo.
La fase liquida rimanente conterrà poi le specie Na+ e OH-, e potrà essere concentrata fino al valore desiderato.
L’elettrolisi è una scelta obbligata anche nella produzione di fluoro, utilizzato nell’ambito della sintesi di polimeri e lubrificanti e nell’industria dei semiconduttori.
Questo elemento è caratterizzato da un estremo potere ossidante; per la sua elevatissima reattività è presente in natura esclusivamente legato ad altri elementi, tipicamente in forma di fluoruro, e non esistono sostanze in grado di ossidarlo.
Per ottenerlo si sottopone una soluzione di acido fluoridrico al processo di elettrolisi, dal quale si liberano F2 e idrogeno.
Un’altra importante applicazione dell’elettrolisi è il processo Hall-Héroult, che permette di ottenere alluminio metallico a partire dalla bauxite che lo contiene: nel processo si procede alla riduzione di Al+ a partire da una miscela di minerali contenenti allumina, che vengono fusi in una cella elettrolitica, sul cui fondo si raccoglie l’alluminio ottenuto.
Restando nell’ambito della metallurgia, tramite processi elettrolitici è possibile raffinare anche a livelli molto spinti diversi metalli, primo fra tutti il rame.
La riduzione dei metalli in corrispondenza del catodo della cella può essere poi sfruttata per creare rivestimenti con cromo, nichel, oro (galvanostegia).
Matteo Giberti


Scrivi un commento